



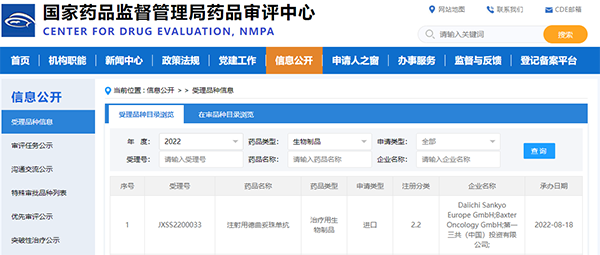
今天,美国食品药品监督管理局国家药品审评中心正式承担了中国共产党第一届第三次会议提交的抗体偶联药物曲妥珠单抗Deruxscan 的上市申请。
该药物用于治疗不可切除或转移性HER2低表达的成年乳腺癌患者,这些患者在转移疾病阶段之前已经接受过至少一次全身治疗,或者在辅助化疗完成期间或之后6个月内复发激素阳性的乳腺癌患者,既往应接受过内分泌治疗或不适合内分泌治疗
这是今年第一次向CDE提交T—DXd的第二个适应症,也是中国第一个针对转移性乳腺癌HER2低表达人群的适应症申请。
T—DXd采用前三家公司专有的DXd—ADC技术,由人源化抗HER2 lgG1抗体,可切割四肽接头和拓扑异构酶I抑制剂组成具有精准靶向,高效低毒的双重优势
本次上市申请基于2022年美国临床肿瘤学学术会议上发表的大规模临床III期研究DESTINY—Breast04的关键数据该数据也发表在《新英格兰医学杂志》上研究数据显示,T—DXd可以治疗所有HER2低表达的转移性乳腺癌患者,无论HER2表达水平与既往化疗相比,所有患者的DESTINY—Breast04评估中位生存期延长6个月
这项研究的结果表明,T—DXd是第一种在HER2低表达人群中显示生存益处的疗法,重新定义了HER2转移性乳腺癌的治疗模式,并为多达一半的乳腺癌患者提供了更有效的治疗选择。
中国DESTINY—Breast04临床试验首席研究员,中国医学科学院肿瘤医院主任医师徐院士表示,DESTINY—Breast04研究是世界上第一个显示HER2低表达人群生存益处的HER2靶向治疗,这意味着它将惠及多达一半目前被归类为HER2阴性疾病但实际上是HER2低表达肿瘤的乳腺癌患者。
DESTINY—Breast04研究旨在评估T—DXd是否可以成为第一种HER2靶向药物,以显示HER2低表达转移性乳腺癌患者的生存益处,我们非常兴奋地看到,测试结果证实了其靶向HER2低表达疾病的能力第一第三共同开发总部总经理绪方恒辉博士表示,T—DXd将重新定义转移性乳腺癌的分类和治疗,使HER2低表达肿瘤患者也能受益于HER2靶向治疗
基于DENSTIY—Breast 04的研究结果,FDA于2022年7月25日受理了曲妥珠单抗deruxiecan的补充生物制品许可申请,并获得了优先审查权日前,在美国获批用于治疗HER2低表达 1+或IHC 2+/原位杂交阴性)的不可切除或转移性成人乳腺癌患者,成为首个也是唯一一个HER2低表达获批的HER2靶向抗体偶联药物(ADC)此前,2022年4月26日,T—DXd被FDA授予乳腺癌领域第三次突破性治疗认可(BTD)
声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。


